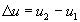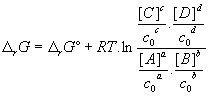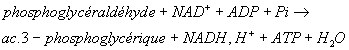Bioénergétique
- Notions de chaleur et
d’enthalpie
- L’énergie interne d’un
système
- Chaque état est caractérisé par un
niveau énergétique = énergie interne
- Ce changement d’état nécessite une
énergie notée :
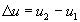
, elle ne dépend que de l’état initial et de
l’état final, pas du chemin.
- Chaleur de réaction à volume
constant
- V = cste à pas de W contre les forces du
poids :
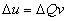
- L’énergie est convertie en chaleur
- < 0 : exothermique
- < 0 : endothermique
- Chaleur de réaction à pression
constante
- Travail d’expansion =
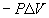
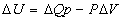
- Variation d’enthalpie
libre
- Définition
- Le passage d’un état 1 à un état 2 peut
se faire dans des conditions particulières et ceci à température
constante
- A pression constante et température
constante, pour une transformation réversible, la fraction d’énergie
utilisable intégralement transformable en travail est appelée variation
d’enthalpie libre
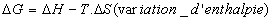
- Symbolique et terminologie utilisée
en chimie
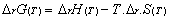
- Conditions standard : 1 mol/L 298 K 1 bar
(1013 hPa)
- Spontanéité d’une
réaction
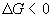 : réaction spontanément possible
(exergonique)
: réaction spontanément possible
(exergonique)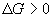 : la réaction n’a lieu que si on apporte de
l’énergie
: la réaction n’a lieu que si on apporte de
l’énergie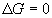 : pas d’évolution ; équilibre
stable
: pas d’évolution ; équilibre
stable- Attention : pas de cinétique
possible
- Simplifications et conventions
adoptées en biochimie
- Variation d’enthalpie
standard
- Réversibilité, p = 1 bar = 1013hPa, T =
298 K
[A], [B], [C], [D] = 1 mol / L
- Relation enthalpie libre et
enthalpie librestandard
- Détermination de l’évolution de la
réaction
- aA + bB « cC + dD
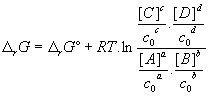
- Simplifications et conventions adoptées en
biochimie
- pour aA + mH+ «
bB
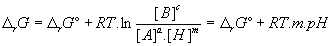
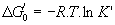
avec K’ : constante d’équilibre apparente à pH
7 (T = 298K ou 310K / H2O=1 même si []=1 mol / L)
- Réactions d’oxydoréduction
- En chimie :
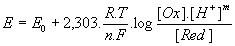
- En biochimie :
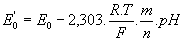 d’où
d’où 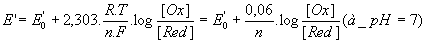
- Relation entre la variation
d’enthalpie et la variation de potentiel redox
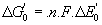
- La réaction est spontanée si
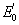 le plus bas réduit
le plus bas réduit
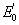 le plus
élevé
le plus
élevé
- Composés et liaisons riches en
énergie
- Notion de couplage énergétique (entre
2 réactions)
- ADP + P « ATP + H20 (
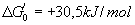 )
)
PEP + H2O « Pyr + P (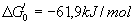 )
)
- La réaction 1 n’est pas possible isoléement
car elle est endergonique donc couplage :
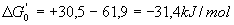
- L’Adénosine TriPhosphate
ATP
- L’AMP : liaison ester
phosphorique
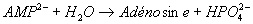 ,
, 
- ADP – ATP : liaison anhydride
phosphorique
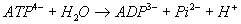 :
: 
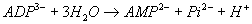 :
: 
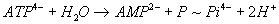 :
: 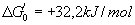
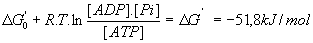 (érythrocyte)
(érythrocyte)
- Autres composés riches en
énergie
- Un composé est riche en énergie si
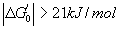
- Rôle et origine des composants riches en
énergie
- Le rôle des composés riches en
énergie
- Transport énergétique dans les réactions du
métabolisme
- Transfert de groupement
- Hydrolyse de l’ATP
- Transports actifs primaires et
secondaires
- Activation des substrats par UTP, ATP, CTP,
GTP
(ex : anabolisme du glucose)
- Transfert de liaisons riches en
énergie
- beaucoup d’ATP sens 2 : muscle au
repos
- très peu d’ATP sens 1 : muscle
activé
- Phosphorylation
- Oxydo-réduction phosphorylantes au niveau du
substrat
- Ex : glycolyse :
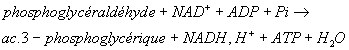
- Oxydations phosphorylantes au niveau des
chaînes respiratoires
- Les chaînes respiratoires
mitochondriales
- La
mitochondrie
- Cycle de Krebs
- Pyruvate-déshydrogénase
 -oxydation des acides gras
-oxydation des acides gras
- Perméable aux petites
molécules
- Membrane interne + crêtes
mitochondriales
- Imperméable à la plupart des petits
ions
- Chaîne de transports
d’électrons
- SuccinoDésHydrogénase SDH
- Complexe F0, F1,
ATPase
- Existence de système de
transports
- Aspect énergétique
général
- NADH + H+ + ½ O2 à
NAD+ + H2O (réaction spontanée)
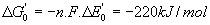
- Rendement :
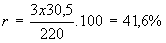
- Description des chaînes : point de
départ et constitution de la chaîne respiratoire
- Séquence de transporteurs
d’électrons
- NADH-FP1 =
FMN-flavoprotéine
- Succinate-FP2 :
FAD-flavoprotéine
- AcylCoA-FP3 :
FAD-flavoprotéine
- Glycérol-P-FP4 :
FAD-flavoprotéine
- Ubiquinone (coenzyme
quinonique)
- Remplacée par le naphtoquinone chez les
bactéries (test
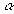 -naphtol de Vosge-Proskauer) ou les plastoquinones chez les
végétaux
-naphtol de Vosge-Proskauer) ou les plastoquinones chez les
végétaux
- UQ = coenzyme liposoluble et voyage donc
dans la membrane interne
- Fonctionnement :
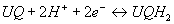
- Hémaprotéine de la membrane
interne
- 3 bandes d’absorption visible et UV (plus
intenses pour les formes réduites)
- Solidement fixés à la membrane interne sauf
le Cyt. c
- Fonctionnement :
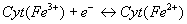
- Cyt b (Cyt b562 et
b566), Cyt c1, Cyt c, Cyt a, Cyt
a3
- Les protéines Fer-Soufre = centres
Fe-S
- Encore appelé fer non héminique
- Fe et S labile en quantité
équimolaire
- Fonctionnement :
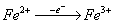
- Associés aux FP et aux Cyt / Poetentiels
variables
- Evolution de la chaîne
respiratoire
- Du plus bas au plus
élevé,
- Quelques différences de systèmes
libres
- Utilisation d’inhibiteurs du transport
d’électrons
- En présence d’O2 et d’un donneur
d’électrons, les transporteurs en amont sont réduits, oxydés en
aval
- Chaîne respiratoire réduite
- Thermodynamique
- Réaction exergonique : récupération
d’énergie sous forme d’ATP
- Les complexes de la
mitochondrie
- Complexe I : NADH-DH &
NADH-UQRedase
- Complexe III : Cyt b1 – UQol –
Cyt c redase : site Q promoteur à éjection de protons vers la mb
interne
- Complexe IV : réaction catalysée par Cyt
c(Fe2+)
à autres systèmes pour éjecter H+ vers le côté externe de la
membrane interne
- Complexe II : succino-DH, Succinate,
Uqred (pas de site de couplage)
- Phosphorylation oxyf)dative
mitochondriale
- Couplage de transport d’électrons, synthèse
d’ATP
- Il y a couplage entre phosphorylation et
transfert d’électrons (les deux phénomènes ne sont pas indépendants). La
phosphorylation (ADP à ATP) contrôle le transfert
d’électrons.
- L’ADP est un activateur de la respiration
mitochondriale
- Les découplants (2-4 dinitrophénol)
abolissent la phosphorylation et stimule le transfert d’électrons (si
suffisamment de NADH, tout O2 est consommé).
- Inhibiteurs de transports d’électrons,
inhibiteurs de synthèse d’ATP
- CN- inhibe le transfert
d’électrons et simultanément la synthèse d’ATP
- La venturicidine / oligomycine inhibent
l’ATP-synthétase
- Le DNP est un agent découplant (la
respiration continue sans synthèse d’ATP)
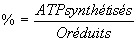
- (NADH)P/O : 3 – (succinate)P/O :
2
- Complexe V (F0-F1
ATPasique)
- La théorie chimio-osmotique de
Mitchell
- Les ions reviennent vers la
matrice
- Le transfert d’électrons provoque
l’expulsion des ions H+ vers le côté externe (
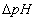 ) à gradient de
protons (augmentation de la différence de potentiel notée
) à gradient de
protons (augmentation de la différence de potentiel notée 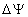 )
)
- La membrane interne est imperméable aux
protons, le retour de H+ par F0-F1
entraîne la synthèse d’ATP

- Thermodynamique :
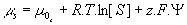
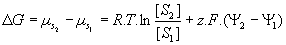
avec F = 96500 et R=8,3
- On a
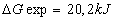 et
et 
Chapitre suivant, Chapitre
Précédent
Table des matières de ce
chapitre, Table des matières générale