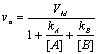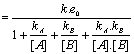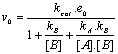- Définition
- Les enzymes sont des protéines
douées d’activité catalytique spécifique
- Naturellement produites
- Action hors des cellules qui les produisent
- Thermolabiles
- On désigne sous le nom de substrat
ce qui va être transformé et produit ce qui découle de la
réaction
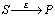
- A une réaction correspond une seule enzyme
- En fait il existe des iso-enzymes élaborées par le même organisme qui catalysent la même réaction mais dont la structure protéique et certaines propriétés physico-chimiques sont légèrement différentes.
- Les enzymes sont des protéines
douées d’activité catalytique spécifique
- Notion de
catalyse
- Réaction d’estérification

hydrolyse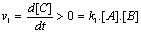
- A l’équilibre
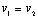
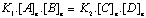
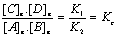
constante caractéristique de l’équilibre à une température donnée
- Modalités de l’action catalytique
- Réaction d’estérification
- Moments historiques de l’enzymologie
- Répartition des enzymes chez
les êtres vivants
- Dans les organes et les
tissus
- D’une façon générale, la répartition des enzymes est analogue à celle des substrats qu’elles peuvent transformer
- Localisation dans les mêmes organes chez les espèces voisines
- Différences immunologiques et de structure à marqueurs tissulaires
- Dans la cellule
- A l’intérieur de la cellule les enzymes sont regroupées e unités fonctionnelles
- Ex : mitochondries, lysozomes
- Dans les organes et les
tissus
- Rappels
- Dénaturation
- Passage d’une structure ordonnée à une structure désordonnée : précipitation
- Rupture des liaisons non -
covalentes et des ponts S-S
- Pont hydrogène
- Liaisons hydrophobes
- Liaisons électrostatiques
- La dénaturation est
réversible au départ, il existe un état intermédiaire :
- Explications principales
- pH extrêmes
- Solvants organiques et détergents
- Action du b-mercapto éthanol
- Dénaturation
- Structure générale des
enzymes
- Protéine monomérique
- Réaction directement sur la protéine
- Site actif = quelques acides aminés
- Arrangement spatial fondamental
- Structure quaternaire :
oligomères
- Autant de sites actifs que de monomères
- Autres éléments
- Cations = cofacteurs métalliques
- Substances organiques : coenzymes
- Nécessite cofacteurs + coenzyme en général
- Protéine monomérique
- Propriétés générales des
coenzymes
- Caractères communs
- Jamais protéique
- Molécule organique de faible masse moléculaire
- Toujours thermostable
- Non responsable de la spécificité
- Apparaissent dans les termes de la réaction
- Retrouvent leur état général in vivo
- Systèmes conjugués (alternances des types de liaisons)
- Les deux types de coenzymes
- Dissociables : coenzymes = transporteur
- Non dissociables : très solidement lié à l’apoprotéine
- Caractères communs
- Le site
actif
- Définition
- Le site actif est une zone constituée de quelques acides aminés localisés dans la zone interne hydrophobe de la protéine et au niveau de laquelle s’exerce la catalyse
- Le site actif est constitué
des acides aminés qui
- Lient les substrats à site de fixation / reconnaissance
- Assurent la catalyse à site catalytique
- Généralités
- Grande diversité
- Caractéristiques : petits, crevasses, hydrophobe, a.a. polaires
- Arguments : substrats petits, enzymes autocatalytiques
- Nature des groupes catalytiques du
site actif
- Seuls certains acides aminés peuvent intervenir dans la catalyse à acides aminés polaires (His, Ser, Cys, Tyr, Lys)
- Théories
- Ajustement induit
- Distorsion dans le substrat
- Exemples de mode d’action du site
actif
- 4 genres de
phénomènes
- Positionnement de la molécule du substrat
- Catalyse covalente : formation d’un acylenzyme (S-E)
- Catalyse générale acide - base (mvt de H+)
- Catalyse nucléophile – électrophile : interactions entre charges positives partielles et charges négatives partielles
- Trypsine
- Ser 183, His 43, (Asp 182)
- S + E à AcylE + HX
- AcylE + H2O + HY
- Chymotrypsine
- Hydrolyse à droite de Phe, Trp, Tyr
- Asp 102, His 52, Ser 195, Gly 193
- Réseau de relais de charges
- Métaloenzymes : mécanisme de catalyse covalente
- Notion de centre
catalytique
- Le centre catalytique d’une enzyme est l’ensemble des groupements fonctionnels de l’enzyme qui participent à l’action catalytique
- 4 genres de
phénomènes
- Définition
- Spécificité de
réaction
- Spécificité
La spécificité est uniquement déterminée par l’apoenzyme- Notion d’isoenzyme
- Enzymes catalysant la même réaction mais qui ont des structures légèrement différentes
- Combinaison de 2 monomères différents
- Spécificité de
substrat
- Spécificité étroite
- Substrat
- Isoméries Z & E avec double liaison
- Isoméries optiques C*
- Produit
- Apparition de C*
- Substrat
- Spécificité large
- Spécificité de
groupe
- 1 enzyme « 1 groupe de substances transformées
- Ex : b-galactosidase
- Spécificité basse
- Action de nombreuses substances
- L’enzyme ne reconnaît que la liaison : on parle souvent de spécificité de liaison
- Ex : broméline
- Spécificité de
groupe
- Spécificité étroite
- Notion de complexe
activé
- Une réaction se réalise
- Avec une vitesse appréciable entre deux espèces moléculaires A et B, pour un nombre de chocs efficaces par unité de temps suffisant
- Dans des conditions
optimales
- Orientation des molécules
- Minimum d’énergie
- Complexe activé
- Si lors d’une collision, les molécules possèdent G* (barrière énergétique), elles forment une association temporaire = complexe activé et peuvent donner A + B
- La vitesse dépend donc du nombre de complexes activés
- Evolution de l’enthalpie libre au
cours d’une réaction
- Intervention de la
potentialité et de la vitesse
- Spontanéité = enthalpie libre DG = G2 – G1
- Energie d’activation : Ea = G* - G1
- Intervention de la
potentialité et de la vitesse
- Une réaction se réalise
- Rôle des catalyseurs et des
enzymes
- G* diminue et Ea diminue pour une réaction donnée
- Ea diminue avec un catalyseur chimique
- Ea diminue fortement avec un catalyseur enzymatique
- Pourquoi Ea diminue avec les
enzymes
- L’enzyme offre à la réaction une voie différente de la voie chimique
- Avec des enzymes, on a plusieurs étapes successives de Ea voisines à apparition de plusieurs intermédiaires réactionnels. Ea global est donc la différence entre S et le plus haut niveau
- Vitesse
initiale
- Généralités
- Pendant la première période : on a un couple qui est une droite : tangente et courbe se confondent, la pente est appelée la vitesse initiale
- Lorsque la vitesse est constante : ordre de réaction 0
- L’augmentation de l’ordre est due à la disparition du substrat et l’apparition des produits
- aA + bB à P
- a et b sont les coeff. de stoechiométrie
- a + b : molécularité = ordre global de la réaction
- a : ordre partiel pour A
- Les 2 ordres des réactions
- Ordre classique
- nA à nA’
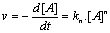 avec
n : ordre de réaction
avec
n : ordre de réaction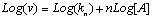
- Ordre initial
- nA à n’A’
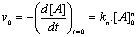
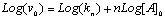
- Ordre classique
- Ordres classiques principaux
- Ordre 0 : [P] = kt
- Odre 1
- A à A’
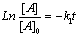 ;
;
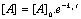
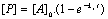
- Ordre 2
- A + B à C
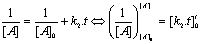
- Cas général
- Ordre 1 réversible
- Généralités
- Variations de
vi
- En fonction de la [enzyme]
- Les réactions enzymatiques sont du 1er ordre par rapport à la [enzyme]
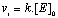
- En fonction de la [substrat]
- Pour doser des enzymes, on préfère utiliser la vitesse maximum qui ne dépend uniquement que de la concentration en enzyme
- En fonction de la [enzyme]
- Etude cinétique de la réaction
enzymatique
- Généralités
- Pour expliquer la spécificité, on est obligé d’admettre que les enzymes forment un complexe transitoire avec le substrat, où il y aura complémentarité entre le substrat et le site actif
- à complexe enzyme – substrat spécifique transitoire
- Equations et constantes de
Michaelis
- Simplification de l’hypothèse générale
- Constante de
Michaelis
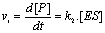
- Hypothèse de l’état
stationnaire :
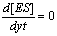
- Loi de conservation de
l’enzyme :
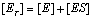
- Constante de Mickaelis :
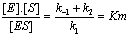
- Equation de
Mickaelis
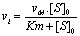
- Méthode de King et Altman
- Equation des vitesses
intégrées :
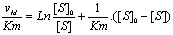
- Représentation de
v0=f([S]0)
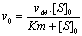
- Valeur particulière : [S]0 = Km
- Détermination de Km et
vM
- vi = f([S])
- Représentation logarithmique : vi = f(Log [S0])
- Représentation en coordonnées
réciproques
- Méthode de Limewover et
Burck :
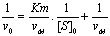
- Méthode de Eodie-Holster :
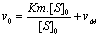
- Méthode de Dixon / Woolf :
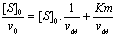
- Méthode de Limewover et
Burck :
- Méthode de Eisenthal –
Cornish Bowden :
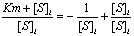
- Equation des vitesses
intégrées :
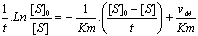
- Interprétation de Km et de
vM
- Km :L’expression de Km est dans certains cas beaucoup plus compliquée que celle vue précédemment
- vM
- Quand nous sommes très près de vM, l’enzyme est saturée, tous les sites actifs sont occupés
- Activité (z)
- L’activité est proche de vM, elle représente une quantité d’enzymes qui donne cette vitesse
- Exprimée en quantité de substrat qui disparaît par unité de temps
- En unités d’activité catalytique : qS / min
- Concentration d’activité
catalytique
- = concentration
catalytique = catc
= activité volumique - Exprimée en U / L
- = concentration
catalytique = catc
- Activité catalytique
spécifique : ACS
- C’est l’activité de l’échantillon divisée par la masse de protéine qui permet cette activité
- Exprimée en U / mg ; cat / mg
- Elle représente un critère de pureté
- Activité catalytique
molaire : ACM
- C’est l’activité catalytique de solution divisée par la quantité d’enzymes
- = nombre de moles de substrat transformées divisées par unité de temps
- Constante catalytique :
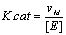
- Activité catalytique par centre actif : = ACM / n
- Mise en évidence du complexe
enzyme – substrat
- Théorie de l’interaction
protéine – ligand
- La dialyse à l’équilibre permet de déterminer Ka et le nombre n de sites pour le ligand
- Une protéine P avec n
sites récepteurs :
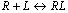
- Equation de
Scatchard :
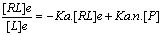
- Théorie de l’interaction
protéine – ligand
- Généralités
- Influence de la
température
- Influence de l’augmentation de la
température sur la cinétique
- Utilisation des basses
températures
- On peut refroidir brusquement un mélange réactionnel pour stopper une réaction enzymatique
- Par contre, il faut éviter un temps trop long et préférer un petit volume
- Relation empirique du
Q10
- Augmentation de 10°C, v x 2 à Q10 = 2
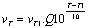
- Relation réelle : loi
d’Arrhénius (théorie des collisions)
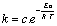
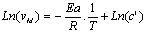
- Calcul de Ea de la réaction
globale :
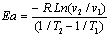
- Utilisation des basses
températures
- Influence de la température sur la
dénaturation
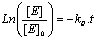
- La dénaturation ne commence qu’après q1
- La valeur de k à une température donnée va varier suivant les conditions du milieu (pH, force ionique, …)
- La vitesse d’inactivation va s’amplifier avec le degré de purification de l’enzyme et varie avec l’origine et la nature de l’enzyme
- Influence de l’augmentation de la
température sur la cinétique
- Influence du
pH
- Explications
- Action du pH sur le substrat : il peut exister sous différentes formes +/- attaquables par les enzymes
- Action du pH sur les
enzymes :
- Sur la stabilité conformationnelle (dénaturation)
- Sur le site de fixation du substrat
- Sur la catalyse
- Action du pH vM et
Km
- Action du pH sur
vM :
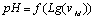
- Action du pH sur vM et Km :
- Action du pH sur Km : peu de variation en fonction du pH
- Le pH0 varie en fonction de l’origine de l’enzyme, du substrat transformé
- L’action du pH varie en fonction de la présence de substances associées et de la durée de la réaction
- On détermine l’activité au pH0 (tamponné)
- Action du pH sur
vM :
- Explications
- Les effecteurs Mickaeliens de
l’activité enzymatique
- Généralités
- Action primaire : action directe de l’effecteur sur l’enzyme
- Action secondaire = indirecte, l’effecteur modifie l’activité en réagissant avec un activateur ou un inhibiteur présent dans le milieu
- Effet réversible : l’effet disparaît dès que l’effecteur est éliminé : diminution de la vitesse d’inhibition
- Effet irréversible : diminution de la vitesse d’activation
- Action des inhibiteurs
- Combinaison entre enzyme et
inhibiteur non indépendante = association exclusive
- Inhibition compétitive : l’enzyme fixe le substrat ou l’inhibiteur, jamais les deux à la fois à complexes binaires ES / EI
- Généralités : ET = E + ES + EI
- Mécanisme
- Cinétique
- Pas de I :
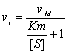
- Avec IC :
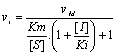
- Détermination de Ki
- Représentation de
Dixon :
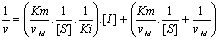
- Principaux cas d’inhibition compétitive : excès de produit / substrat
- Pas de I :
- Combinaisons entre l’enzyme
et l’inhibiteur indépendantes : associations
non-exclusives
- Inhibition non-compétitive :
récepteurs pour I et S différentes à complexes ternaires
ESI
- Modifications
cinétiques
- Pas de variation de Km
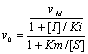
- Représentation de
Dixon :
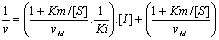
- Cas de l’inhibition mixte (à éviter !)
- Mécanisme
- Modifications
cinétiques
- Inhibition incompétitive :
récepteurs pour I et S différents à I se fixe après S,
complexes ternaires ESI
- Modifications
cinétiques
- Diminution de vM et Km
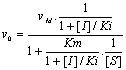
- Mécanisme
- Modifications
cinétiques
- Inhibition non-compétitive :
récepteurs pour I et S différentes à complexes ternaires
ESI
- Combinaison entre enzyme et
inhibiteur non indépendante = association exclusive
- Action des activateurs
Mickaeliens
- Augmentation des vitesses de réaction
- Activateurs non modifiés
- Ions métalliques
- Associations
réversibles
- Association au hasard
- Mécanisme séquencé
- Généralités
- Les effecteurs
allostériques(action sur les enzymes allostériques non
mickaeliennes)
- Caractéristiques cinétiques et
structurales des enzymes allostériques
- Généralités
- Km apparent : vM / 2
- Coopérativité : dès qu’il y a fixation d’un S, il y a modification de la structure du monomère qui a fixé S, cette modification se transmet aux sous-unités voisines qui vont fixer S plus facilement.
- Définition des enzymes
allostériques
- Oligomères de type quaternaire, axe de symétrie
- Effet coopératif entre les
molécules de S : affinité croissante
- Enzymes de type K : effet coopératif homotrope (même catégorie de S), sigmoïde
- Enzymes de type v : pas de coopération, effet hétérotrope (entre sites différents), hyperbolique
- Les deux états
conformationnels
- [S] faible, état défavorable T
- [S] élevé, état favorable R
- Le passage de T à R se fait par transition allostérique
- Les deux théories
- Théorie de Koshland
- Théorie de Monod Wyman Changeux MWC
- Les ligands vont stabiliser l’enzyme dans l’état T ou R suivant la nature du ligand
- Les deux catégories d’enzymes
allostériques
- Type K
- v = f([S]) sigmoïde
- Effets coopératifs
- Km varie ; vM ne varie pas
- Représentation de
Hill :
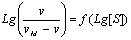
- Coeff. directeur :
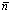 , indice de coopérativité
, indice de coopérativité - y = 0 à x = Km apparent
- Coeff. directeur :
- Type V
- VM varie, Km ne varie pas
- Disparition de la sigmoïdicité
- Coopérativités homotropes
- Type K
- Généralités
- Action des effecteurs
allostériques
- Exemples
caractéristiques
- Biosynthèse de la L-Ile à partir de la Thr
- Synthèse de nucléotides pyrimidiques par l’aspartate transcarbamylase
- Les inhibiteurs
allostériques
- Les activateurs allostériques
- Exemples
caractéristiques
- Action des agents de
désensibilisation
- La sensibilité à un effecteur allostérique peut disparaître sous l’effet d’un traitement chimique (Hg / urée / F.ion.) ou physique (congél. / décongèl.)
- La désensibilisation entraîne une normalisation de la cinétique à courbe hyperbolique
- Multiplication de la coopérativité, suppression des interactions
- Importance des enzymes allostériques
dans les chaînes de biosynthèse
- Chaînes de biosynthèse linéaire
- Chaînes ramifiées
- Inhibition concertée
- Inhibition cumulative
- Inhibition différentielle
- Inhibition étagée
- Caractéristiques cinétiques et
structurales des enzymes allostériques
- Les
coenzymes
- Rappels
- Molécules organiques
nécessaires à l’activité enzymatique
- Activateurs : liés à l’apoprotéine
- Transporteurs : co-substrats
- Jamais de nature protéique
- Toujours régénérés
- Molécules organiques
nécessaires à l’activité enzymatique
- Les vitamines
- Tous les coenzymes dérivent des vitamines
- Une vitamine est une substance organique qui doit être fournie dans l’alimentation en très petite quantité, d’une façon continue, pour permettre le fonctionnement de l’organisme.
- Classification
- Coenzymes des oxydoréductases
- Les nicotinamides
nucléotides
- Vitamine impliquée dans la
structure
- Amide nicotinique = B3 = PP
- Provitamine = acide nicotinique
- B3 à NAD+ / NADP+
- La structure du NAD+
- Les propriétés
- Absorbance max : l = 260, 340 nm
- Fluorescence (émission à 460 nm)
- Travail en milieu tamponné pour la stabilité
- Réactions d’oxydoréduction
- Vitamine impliquée dans la
structure
- Les flavines
nucléotides
- Vitamine impliquée dans la
structure
- B2 = riboflavine = lactoflavine
- = colorant E101 (jaune)
- très sensible à la lumière
- Les coenzymes qui dérivent
de la vitamine B2
- FMN : Flavine MonoNucléotide
- FAD : Flavine Adénine Dinucléotide
- Mécanismes d’action
- Coenzymes très fortement liés à la protéine = flavoprotéine
- Deux formes semi-quinoniques
- Vitamine impliquée dans la
structure
- Les coenzymes
hématiniques
- Fortement liés aux protéines
- Structure tétrapyrolyque centrée sur un atome de Fe2+
- Fonction : CytFe3+ ó CytFe2+
- Autres enzymes
d’oxydoréduction
- Acide lipoïque
- à intervention dans les décarboxylations
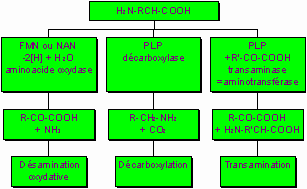
- Les nicotinamides
nucléotides
- Les coenzymes de transfert de
groupement
Pyridoxal-Phosphate (PLP ; PALP) Thiamine PyroPhosphate (TPP+ ; DPT+) Coenzyme A Coenzymes du métabolisme des radicaux monocarbonés Vitamine Vitamine B6 = pyridoxine (hydrosoluble) Vitamine B1 = thiamine Vitamine B5 = acide panthaténique Acide folique = B9 à Acide Tétra HydroPholiq. Vit. B12 à CoEnz B12
Adénosyl Méthionine (-CH3)
Vit. B8 à Biotine
Coenzyme PLP ( 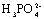 -B6)
-B6)TPP+ (Thiam.- 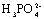 )
)CoA-SH Mécanisme Transamination des AA
Décarboxylation des AA
Clivage des AA
EliminationSystème ping-pong avec nbx liaisons (ioniques, hydrogène hydrophobes)
Décarboxylation oxydative des Aacéto Décarboxylation simple des Aacéto
-SH se fixe aux –COOH à acylcoezyme A R-CO~SCoA
- Rappels
- Cinétique michaélienne à deux
substrats
- A + B ó P + Q (intervention d’un coenzyme transporteur). Si B = H2O ; on ramène à 1 seul substrat. Il existe des mécanismes * complexe ternaire (EAB). et des complexe binaire (EA ou EB). On parle de * système séquentiel (SS – PP). * système non séquentiel (S – P – S – P¨)
- Système à complexe binaire
(bi-bi)
- Système ping pong
- Non séquencé ; ordonné
- Réaction à double déplacement
- Un seul site de fixation pour le substrat
- Cinétique
- Mécanisme de Theroell et
Chance
- E + A ó EA || EA + B ó E + P + Q
- Système ping pong
- Cinétique à complexe ternaire
- Mécanismes d’association
aléatoire substrat – enzyme (bi-bi aléatoire)
- Cas général : associations
de A et de B avec E dépendantes
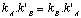
- Représentation de Cleland
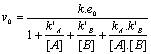
- Représentation
secondaire :
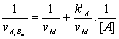
- Cas simplifié : association
indépendante à KA et KB
- Représentation de
Cleland
- Représentation
secondaire :
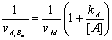
- Représentation de
Cleland
- Cas général : associations
de A et de B avec E dépendantes
- Mécanisme ordonné (bi-bi
ordonné)
- E + A ó EA ó EAB à E +P + Q
- Représentation de
Cleland
- Equation des
vitesses
- Détermination des
constantes :
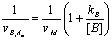
- Equation des
vitesses
- Détermination du
mécanisme réactionnel
- Graphiquement :
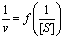
- Inhibiteurs par excès de produit
-
Mécanismes
Produits
Substrat variable
Ordonné bi-bi
Theorell / Chance bi-bi
Ping-pong bi-bi
Aléatoire bi-bi
P
QP
QP
QP ou Q
A
B
B non - saturant
B saturant
A non - saturant
A saturant
NC
CNC
CNC
CC
IC
C-
C-
C-
NC
NCC
NCC
NCC
NC
-C
-C
--
- D’après l’action des
analogues structuraux
- B’ IC de E pour B, A cst, B’ analogue structural de B
- B fixe, A
variable en présence de B’ à mécanisme aléatoire à
complexe ternaire (INC de E pour A, B fixe)
un site pour S, un site pour I - Ou à mécanisme
ordonné à complexe ternaire (II pour A, B
fixe)
un site pour A, un site pour B’ = site de B
- Graphiquement :
- Remarque : réversibilité des réactions enzymatiques (Réaction de Maldane, cinétiques à deux substrats)
- Mécanismes d’association
aléatoire substrat – enzyme (bi-bi aléatoire)