Les
méthodes d’étude de la cellule
- Les techniques microscopiques
- La microscopie photonique
- Généralités
- Définition : examen d’objets agrandis en présence de
photons (UV & visible)
- Domaines d’application : jusqu’à 0.2 µm
- Le microscope à fond clair
- Description
- Partie mécanique
- Statif
- Tube binoculaire
- Tube porte objectif
- Partie optique
- Source lumineuse
- Système condenseur – diaphragme
- Objectifs 4x/10x/40x/100x
- Oculaires 10x/…
- Principe de formation de l’image
- Objectif à image agrandie inversée réelle
- Oculaire à image intermédiaire agrandie inversée
virtuelle
- Caractéristiques essentielles du microscope
- Ouverture numérique : ON = n . sin a
- Limite de séparation :
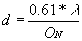 Pouvoir de résolution : 1/d
Pouvoir de résolution : 1/d- Grossissement : G = g1 . g2
- Applications
- Histologie
- Hématologie
- Parasitologie
- Bactériologie
- Le microscope à fond noir
- Principe
- Eclairage par un condenseur à fond noir
- Aucune lumière ne pénètre dans l’objectif
- Observations des contours de la cellule par
diffraction
- Applications
- Bactériologie
- Le microscope à contraste de phase
- Principe
- Objectif avec anneau de phase intégré
- Modification de la phase des rayons lumineux à variation
d’intensité lumineuse
- Applications
- Observation de cellules vivantes
- Le microscope à fluorescence
- Principe de la fluorescence
- C’est l’émission de lumière suite à l’absorption de
photons
- E = h . n = h . c/l ó l2 > l1
- Différents types de fluorescence
- Primaire : produite naturellement par certaines
substances biologiques (ex : chlorophylle)
- Secondaire : obtenue artificiellement en liant un
composé non fluorescent avec un composé fluorescent
(fluorochromes)
- Les microscopes à fluorescence
- A lumière transmise
- A lumière réfléchie (épifluorescence)
- Applications
- Bactériologie (cytométrie sur filtre)
- Immunofluorescence
- Le microscope confocal
- Principe
- Ce microscope permet de collecter l’image réfléchie au
niveau d’un plan focal et d’éliminer les images du dessus
(dessous) de ce plan par balayage laser
- Applications
- Neurobiologie
- Préparation des échantillons en microscopie optique
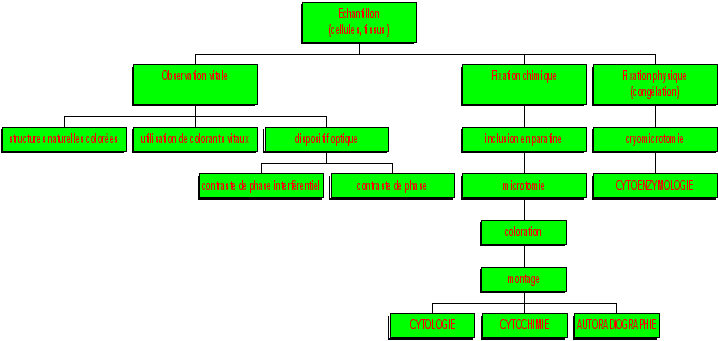
- La microsopie électronique
- Le microscope électronique à transmission
- Principe
- On diminue la limite de séparation en diminuant la
longueur d’onde d’excitation à utilisation des électrons à
la place des photons
- Caractéristiques
- d = 1 nm
- G = de 1400x à 500 000x
- Description
- Canon à électrodes
- Accélérateur d’électrons
- Lentille électromagnétique
- Ecran fluorescent de visualisation
- Le microscope électronique à balayage
- Principe
- Les cellules sont traitées par des sels de métaux
lourds
- Les électrons émis par la cathode vont balayer la
surface de la cellule
- Caractéristiques
- d = 10 nm
- G = 20 000x
- Applications
- Biologie cellulaire
- Préparation des échantillons
- Coloration positive
- Fixation chimique
- Déshydratation
- Inclusion dans la résine
- Coupes de 50 à 100 nm
- Dépôt de sels de métaux lourds à augmentation du
contraste
- Coloration négative
- Les sels de métaux lourds se déposent après évaporation
de l’eau autour des particules
- Ombrage de particules & réplication de surface
- Réalisation de répliques quand la surface est trop
épaisse pour être traversée par les électrons
- Cryodécapage & cryofracture
- Cryofracture
- Congélation des organites dans l’azote
liquide
- Fracture du bloc
- Réplication par ombrage
- Cryodécapage
- Congélation ultra rapide
- Fracture de l’échantillon
- Sublmation de l’eau sous vide
- Réplication
- Les techniques de fractionnement des constituants
cellulaires
- Préparation de l’homogénat cellulaire
- Méthodes permettant la rupture de la membrane plasmique
- Mécanique : broyage
- Choc osmotique
- Congélations décongélations successives
- Ultra-sons
- Attaque enzymatique
- Précautions à respecter pour obtenir un bon homogénat
- Liquide isotonique
- Basse température
- En présence d’agents réducteurs
- PH neutre
- La séparation des organites
- Par centrifugation différentielle
- Augmentation de la vitesse et du temps
- Par centrifugation en gradient de densité (ultracentrifugation)
- Principe : séparation des organites en fonction de leur
constante de sédimentation, fonction de leur masse molaire
- Séparation en solution de saccharose de 5 à 20 %
- Dépôt des organites en surface
- Centrifugation : arrêt de la migration quand les
organites rencontrent une couche de saccharose de densité
supérieure à la leur
- Séparation des organites en fractions ( =
aliquotes)
- Suivi de la séparation des fractions
- Utilisation de marqueurs moléculaires des organites
- Ce sont des enzymes caractéristiques de ces
organites
- On peut aussi évaluer la purification par
microscopie
- Applications
- Utilisation de systèmes cellulaires
- Ex : synthèses protéiques in vitro
- Techniques de marquage cellulaire
- Techniques cytochimiques et immunocytochimiques ;
techniques cytoenzymologiques
- Techniques cytochimiques
- Mise en évidence d’un composé chimique de la cellule au
microscope optique/électronique
- Techniques immunocytochimiques
- En microscopie optique
- En microscopie électronique
- Techniques cytoenzymologiques
- Mise en évidence dans une cellule de protéines à activité
enzymatique
- Techniques de marquage isotopique
- Principaux isotopes utilisés en biologie
- X(A, Z) : A différent, Z identique
- Isotopes non radioactifs : 15N
- Isotopes radioactifs : a, b, g
- 3H ; 14C ; 131I ;
32P ; 35S
- Dosage de la radioactivité dans un compteur à
scintillation
- Détection qualitative de la radioactivité ; localisation de
molécules radioactives dans la cellule par autoradiographie
- " pulse chase "
- On place une coupe de tissus dans un milieu nutritif
contenant de la Leu radioactive
- L’acide aminé est incorporé dans la protéine
- Coupes de tissus dans un milieu contenant de la Leu
froide.
- On peut donc observer le déplacement de la Leu dans la
cellule
- Localisation : autoradiographie
- On recouvre la coupe cellulaire d’une émulsion
photo
- Les rayons ionisants ont dégagés
- Apparition de grains d’argent précipités
Chapitre suivant, Chapitre Précédent
Table des matières de ce
chapitre, Table des matières générale
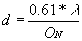 Pouvoir de résolution : 1/d
Pouvoir de résolution : 1/d