- Définition générale
- C’est une glycoprotéine douée d’activité anticorps
- Présentes dans le plasma, la lymphe, les sécrétions digestives
- Synthétisées par les Lymphocytes B et plasmocytes
- On distingue 5 classes
- Immunoglobuline G
- Immunoglobuline A
- Immunoglobuline M
- Immunoglobuline D
- Immunoglobuline E
- Bifonctionnelle
- Partie N terminale : site de reconnaissance de l’épitope
- Partie C terminale : déclenche les effets bio induits par le complexe paratope – épitope
- C’est une glycoprotéine douée d’activité anticorps
- Obtention des immunoglobulines
- Méthode biochimique
- Chromatographie d’immunoaffinité
- Autres méthodes de séparation
- Précipitation des globulines par
- Sels d’ammonium (relargage)
- Des solvants (éthanol à froid)
- Différentes chromatographies
- A échange d’ions
- A gel filtration (ternissage moléculaire)
- Electrophorèses et immunoélectrophorèses
- Précipitation des globulines par
- Obtention d’immunoglobulines à partir de sérums malades
- Multiplication d’un clone de plasmocytes cancéreux (myélome) è immunoglobuline monoclonale
- Réalisation des hybridomes
- Fusion d’un lymphocyte B spécifique avec un antigène donné
- Multiplication de plasmocytes cancéreux, non sécréteurs d’immunoglobulines
- Méthode biochimique
- Structure des immunoglobulines
- Structure générale (modèle de base)
- Tétrapeptide constitué d’associations
- De 2 chaines lourdes H (identiques)
- De 2 chaînes légères L (identiques)
- Liées à
- Des ponts disulfures inter chaîne
- Des ponts hydrogène
- Ces chaînes sont glycosylées (sur la chaîne H)
- Zone flexible, appelée zone charnière (sur la chaîne H) pour mieux s’adapter à l’épitope
- Tétrapeptide constitué d’associations
- Structure détaillée de l’immunoglobuline
- Organisation des chaînes H et L en domaines
- Domaine = portion peptidique d’une centaine d’acides aminés maintenus par des ponts disulfure intrachaîne
- Structure spatiale en feuillet B antiparallèle
- Domaines de 2 types
- Domaines constants C (très peu variable, partie C terminale, CH et CL)
- Domaines variables V (très variable, partie N terminale, site anticorps, VH et VL)
- Organisation des chaînes H
- CH selon l’immunoglobuline
- Responsable de la classe
- Organisation des chaînes L
- Il existe 2 régions CL et VL
- On distingue deux types : l et k
- Notation : IgG = g2l2 ou g2k2
- Il existe 2 régions CL et VL
- Zone hypervariable VH et VL
- Il existe de régions hypervariables appelées CDR
- Ces régions correspondent à la zone d’interaction AG-AC
- Il existe des régions moins variables entre les CDR : les FR (FRamework)
- Organisation des chaînes H et L en domaines
- Structure générale (modèle de base)
- Relation entre structure et activité biologique
- Mise en évidence de la dualité fonctionnelle de
l’immunoglobuline
- Coupure enzymatique (obtention de petits fragments plus
faciles à analyser)
- Coupure à la papaïne : coupe la chaîne H à gauche du S-S, obtention de 2 Fab
- Coupure à la pepsine : coupe la chaîne H à droite de S-S, obtention d’un fragment Fab’2
- Coupures chimiques
- Par un agent réducteur (2 mercaptoéthanol : HS-CH2-CH2OH), coupure des liaisons S-S
- Par l’urée, coupure des liaisons HN=O=
- Coupure enzymatique (obtention de petits fragments plus
faciles à analyser)
- Propriétés liées au fragment Fab, au fragment Fc
Fragment Fab
Fragment Fc
Nature : VH et VL
Taille : 5 à 10 acides aminés
Flexibilité
Spécificité : épitopes séquentiels et conformationnels
Affinité du site anticorpsPas de spécificté avec l’antigène
Fixation du complément
Fixation sur certaines cellules : cytophilie
Passage trans-placentaire
- Mise en évidence de la dualité fonctionnelle de
l’immunoglobuline
- Caractères structuraux et fonctionnels des différentes classes d’immunoglobulines
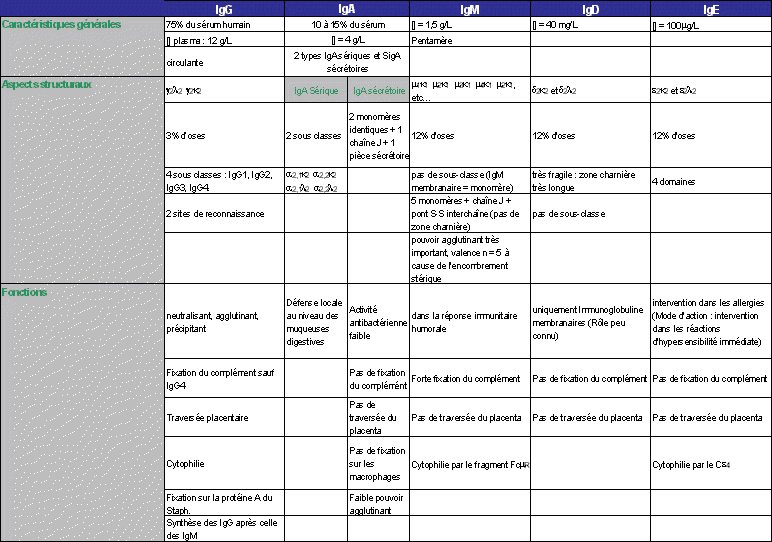
- Les propriétés antigéniques des
immunoglobulines
- Isotopes
- Anticorps dirigé contre des déterminants antigéniques communs aux individus d’une même espèce
- Localisation sur la partie constante des chaînes légères
- Réactions croisées entre des chaînes g et a d’une même espèce
- Les allotypes
- Déterminants antigéniques sont présents chez certaines catégories d’individus au sein de la même espèce
- Localisation sur les parties CL et CH
- Les idiotopes
- Déterminants antigéniques caractéristiques de la cellule, à l’origine de la synthèse d’anticorps
- Localisés à proximité ou dans le paratope
- Les idiotypes
- Mise en évidence expérimentale (Jacques Oudin)
- C’est la somme des idiotopes présents sur l’immunoglobuline VH et VL
- Isotopes
- Structure des récepteurs des lymphocytes B
- L’immunoglobuline membranaire
- Spécifique de l’antigène
- Monomérique
- Segment supplémentaire dans le Cµ4 (IgM)
- Les hétérodimères
- Molécules protéiques ayant de fortes analogies avec les immunoglobulines
- Elles font partie de la super famille des immunoglobulines
- Transmission du signal d’activation du LB
- L’immunoglobuline membranaire