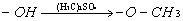Les
Monosaccharides
- Généralités
- Caractères
généraux
- Pas hydrolysable par des acides
faibles à chaud
- On distingue deux
groupes
- Constitués uniquement de C, H,
O : monosaccharides vrais
- Constitués de C, H, O, N et
autres : dérivés de monosaccharide
- Définition
- Constitution
- CnH2nOn ou
Cn(H2O)n
- Une fonction
carbonyle
- Aldéhyde à
aldose
- Cétonique à
cétose
- Des fonctions alcool sur les
autres C (au moins 2)
- Exemples
- Aldose le plus simple :
glycéraldéhyde
- Cétose le plus simple :
dihydroxyacétone
- Classification
- Nombre d’atomes de carbone
- Trioses
- Tétroses
- Pentoses
- Hexoses
- Heptoses
- Nature de la fonction
carbonyle
- Aldéhydique
- Cétonique
- Formule linéaire du
glucose
- Formule
brute
- C6H12O6
- 180g/mol
- formule semi
développée
- CHO–CHOH–CHOH–CHOH–CHOH–CH2OH
- Présence de carbones asymétriques
à isomères optiques
- Formule
développée
- Obtention par synthèse d’un ose à un
carbone de plus ou moins
- Synthèse de Killiani Fisher
(acide cyanhydrique HCN)
obtention de deux épimères = oses ne différant que
par la position de la fonction –OH portée par le même
C
- Dégradation de Wöhl
(hydroxylamine NH2OH)
- On peut alors établir la
filiation des oses
- Conséquences des
filiations
- Chaque ose peut être rattaché à
un triose de départ
- A chaque isomère de la série D (
-OH du dernier C à droite) correspond son énantiomère dans la
série L avec les mêmes propriétés physico-chimiques (sauf
[a])
- Formules cycliques
- Objections à la formule
linéaire
- Perméthylation du glucose
- Par le sulfate diméthylique
(H3C)2SO4
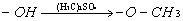
- Or expérimentalement :
fixation de 5 –CH3 au maximum, il existe donc 2 –OH
qui ne sont pas libres
- Réaction avec un alcool
- Normalement : aldéhyde +
alcool à acétal
- Or on ne peut fixer qu’un
seul –OH au niveau de la fonction –CHO
- L’ose naturel est donc sous
forme cyclique, présence d’un C hémyacétalique
- Forme pyrannique des
oses
- Représentation de Tollens
- Dérivé d’un cycle
pyrannique
- Apparition d’un *C
supplémentaire
- Représentation de Haworth
- Le cycle est face au
plan
- Les 5 C et le O ne sont pas
dans le même plan
- Forme chaise et forme
bateau
- Forme
furannique
- Dérivé d’un noyau
furannique
- Les aldohexoses se cyclisent en
forme pyrannique, les cétohexoses en forme
furannique
- Les 4 C et un O sont dans le même
plan
- Les propriétés des
monosaccharides
- Propriétés
physiques
- Solubilité
- Très soluble dans
l’eau
- Si concentration trop
importante, formation de cristaux
- Peu soluble dans
l’éthanol
- Insoluble dans
l’éther
- Saveur : sucrée
- Pouvoir rotatoire [a]
- Lié à la présence d’un *C,
donne l’angle de déviation (en
g-1dm-1mL)
- a (°)=
[a].C.l
- Phénomène de mutarotation
- Deux anomères possibles sur
le C hémiacétalyque : a et b, le phénomène de mutarotation est
le changement progressif de l’angle de déviation de la lumière
polarisée
- Techniques chromatographiques
- Chromatographie sur
papier
- Chromatographie sur Couche
Mince
- High Performance Liquid
Chromatography
- Chromatographie en Phase
Gaz
- Transformation en dérivé
triméthylsilylé
- Propriétés
chimiques
- Stabilité
-
| |
Milieu
acide |
Milieu
basique |
| Faible |
Stable |
Epimérisation et mutarotation accélérée |
| Fort et à chaud |
Déshydratation en dérivé du furfural |
Oxydation : ils réduisent des composés minéraux et
organiques |
- Dues à –COOH
- Oxydation des oses
- –C1 oxydé par I2
ou Br2 à acide aldonique
- –C6 oxydé par I2
ou Br2 à acide uronique
- –C1 et –C6 oxydés par
HNO3 à chaud à acide arique
- Oxydation par
HIO4 coupe les chaînes carbonées des
a-glycérols
- Propriétés
réductrices
- Complexes métalliques
(réactions non stoechiométriques)
- Cu2+ à
méthode de Fehling et méthode de
Bertrand
- Hg2+ à
méthode de Baudoin Lewin
- Fe3+ à
méthode de Hagedorn Jensen
- Composés organiques
- Acide
3,5-DiNitroSalicylique (3,5-DNS)
- Réactions d’addition et de
substitution
- Action des alcools et des
phénols à formation d’une liaison osidique au niveau du
carbone hémyacétalique
- Action de l’acide
cyanhydrique HCN (Killiani Fischer)
- Action d’une amine
(Wöhl)
- Action de l’acide
phosphorique (H3PO4)
- Réduction en
polyalcool
- Aldose à 1 isomère unique
(ex : glucose à sorbitol)
- Cétose à 2 polyalcools
épimères (ex : fructose à sorbitol + mannitol)
- Dues aux –OH
- Estérifications (action
d’acides)
- Ethérification (action
d’alcools)
- Due à –OH et –COOH
- Condensation avec la
phénylhydrazine à osazone
- Les oses ou monosaccharides d’origine
biologique et leurs dérivés
- Nombre de
carbones
- Trioses et tétroses
- D-Glycéraldéhyde à 3
Phospho-D-Glycéraldéhyde
- DiHydroxyAcétone à
PhosphoDiHydroxyAcétone
- D-Erythrose à
D-Erythrose-4-Phosphate
- Pentoses
- D-Ribose (acides nucléiques,
coenzymes)
- L-Arabinose
- Hexoses
- D(+)-Glucose : très répandu
chez tous les organismes, libre et combiné
- D(+)-Mannose : peu abondant à
l’état libre
- D(+)-Galactose : constituant
du lactose du lait, …
- D(-)-Fructose : à l’état
libre et dans les osides (saccharose)
- L(-)-Sorbose : oxydation du
D-Sorbitol
- Fonctions
- Les désoxyoses = désoses
- 1 O en moins au niveau du C2
d’un aldose
- parfois en C6
- les osamines
- La fonction –OH en C2 est
remplacée par –NH2
- Très instable, plus courant
sous sa forme N-acétylée
- Les dérivés des osamines
N-acétylées
- Acide N-Acétyl
Muranique
- Acide neuraminique
- Cétose à 9C : acide
pyruvique + D-Mannosamine à A neuramin.
- Inexistant à l’état libre,
se rencontre combiné à acides sialiques
- Les acides uroniques
- La vitamine C : acide L-ascorbique
C6H8O6
Chapitre suivant, Chapitre Précédent
Table des matières de ce
chapitre, Table des matières générale